在制药领域,个性化医疗需求日益增长,3D 打印技术凭借可定制剂量、复杂结构成型等优势,成为口服药物递送系统(DDS)研发的重要方向,被称为“printlets”的3D打印口服制剂可通过熔融沉积建模(FDM)、选择性激光烧结(SLS)及vat光聚合(VPP)等多种方法制备,其中VPP技术(含立体光刻SLA、掩膜立体光刻MSLA、数字光处理DLP)因高精度、高分辨率和高制造速度,在DDS领域极具应用前景。 然而,3D打印DDS研发面临两大关键挑战。一方面,现有表征方法存在局限。传统表征技术如重量法(测水吸收、侵蚀)仅能分析静态结构,X射线显微断层扫描(XmCT)虽能提供一定结构信息,但均无法捕捉药物释放过程中动态的传质现象,尤其是涉及双流动相(如水与低分子量液态聚合物)的界面作用;另一方面,3D
打印DDS的传质机制尚不明确。这类系统常包含固体交联聚合物(如聚乙二醇二丙烯酸酯PEGDA)与液体流动相(如低分子量聚乙二醇PEG),药物释放与“水渗入- PEG渗出”的双向传质过程紧密耦合,但该过程如何影响药物释放速率的具体机制尚未清晰。
在本研究中,低场时域核磁共振技术是突破传统表征局限、揭示3D 打印DDS传质机制与药物释放关联的关键,其核心价值体现在精准区分质子类型、量化动态传质及弥补其他技术短板三个方面,为研究提供了不可替代的分子水平证据。

图1: 3D 打印DDS在未水合(as – printed,左列)与水合24h(右列)两种状态下的T1-T2图谱
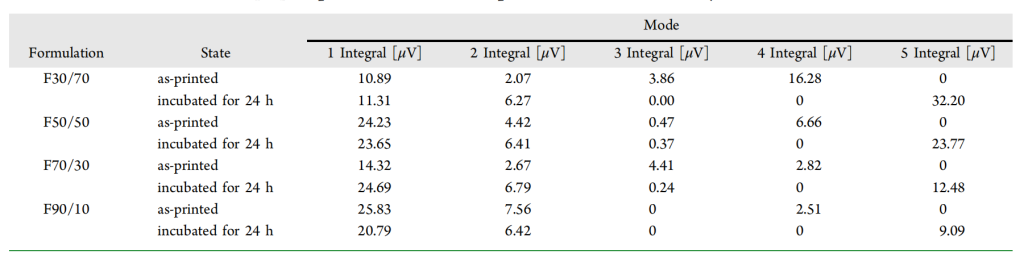
表 1. 3D打印DDS未水合与水合24h两种状态下的T1-T2图谱所获数据
图 1 是本研究通过 LF- NMR 技术获取的核心结果图,采用反转恢复IR – CPMG脉冲序列采集数据,经快速迭代收缩阈值算法(FISTA)分析得到。该图以二维热力图形式,直观呈现了3D打印DDS在未水合(as – printed,左列)与水合24h(右列)两种状态下矩阵中不同质子池的分布与动态变化,是理解双流动相传质机制的关键可视化证据,以下从基础信息、不同状态下的质子池特征、科学价值三方面进行详细解析。
图 1 按 4 种 PEGDA/PEG 质量比的制剂(F30/70、F50/50、F70/30、F90/10,从上至下排列)和 2 种状态(未水合、水合 24h,左右两列)分为 8 个子图,每个子图对应 1 种制剂的 1 种状态。所有样本均通过 MSLA 3D 打印制备,核心差异在于流动相(PEG 400)含量,F30/70 含最高 PEG(67.9% w/w),F90/10 含最低 PEG(9.7% w/w),通过这种变量设计,可清晰考察流动相含量对质子池动态变化的影响。
纵轴(T₁,单位:秒,s):代表纵向弛豫时间,反映质子与周围环境(如聚合物、溶剂)的能量交换速率,通常情况下,流动性越低的质子(如交联聚合物的束缚质子),T₁越长。
横轴(T₂,单位:毫秒,ms):代表横向弛豫时间,反映质子间的自旋-自旋相互作用速率,流动性越低的质子(如半固态 PEG、束缚水),T₂越短。
颜色梯度(右侧色标):表示信号积分强度(单位:微伏,μV),颜色越深(如红色、橙色),对应质子池的含量越高;颜色越浅(如蓝色、紫色),含量越低。
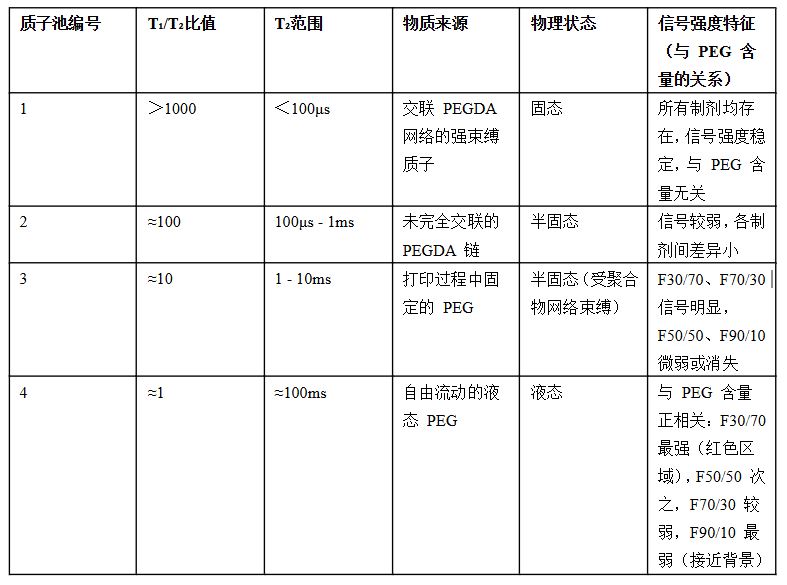
未水合的3D 打印矩阵中,质子主要来源于交联聚合物(PEGDA 700)、流动相(PEG 400)及药物(RH,因含量低,信号可忽略)。图 1左列通过T₁ – T₂图谱清晰区分出 4种质子池,且各质子池的分布与PEGDA/PEG 比例直接相关。
根据 T₁/T₂比值(比值越接近 1,质子流动性越高;比值越大,流动性越低)和 T₂范围,未水合样本的质子池可分为 4 类,具体特征如下表所示:
部分制剂(如 F50/50、F70/30)水合后,在 T₁≈1 – 10s、T₂≈1 – 10ms 处仍有微弱信号(质子池 3 残留,表 1 中积分强度分别为 0.37μV、0.24μV),这是 MRI 无法检测的 “低流动相残留”。MRI 仅能捕捉 T₂>10ms 的自由水,而 LF-NMR 凭借高灵敏度可检测到被聚合物网络轻微束缚的残留 PEG,这一现象解释了为何 F70/30 的药物释放速率(24h 87.2%)慢于 F30/70(24h 99.3%),即残留 PEG 阻碍了水的进一步渗入,延缓了药物溶出。
本研究以 3D 打印 RH 长效 DDS 为研究对象,针对传统表征技术无法捕捉动态传质、传质机制不明等问题,引入 LF-NMR 技术,通过图 1的 T₁ – T₂关联图谱,清晰揭示了 “PEG 渗出 – 水渗入” 的双向传质机制及其与药物释放的关联。在实际应用中,该研究成果可指导 3D 打印 DDS 的处方优化(如根据药物释放需求调整 PEGDA/PEG 比例)、质量控制(通过 T₁ – T₂图谱判断批次一致性),同时为其他 3D 打印制剂(如多孔 SLA 制剂、FDM 制剂)的传质机制研究提供了可推广的技术范式。LF-NMR 技术凭借其精准区分质子池、量化动态传质的优势,成为 3D 打印 DDS 研发与应用中的关键技术支撑,推动了 3D 打印药物从 “技术实现” 向 “功能可控” 的跨越,为个性化医疗的发展提供了重要助力。
Baran E, Birczynski A, Milanowski B, et al. 3D Printed Drug Delivery Systems in Action—Magnetic Resonance Imaging and Relaxometry for Monitoring Mass Transport Phenomena[J]. ACS Applied Materials & Interfaces, 2024, 16(40): 40714-40725. https://doi.org/10.1021/acsami.4c08501
电话:400-060-3233
售后:400-060-3233


返回顶部